29 Nov 2001 Los bancos de sangre de cordón umbilical. Una nueva contribución al tratamiento de las enfermedades hematológicas
J. García (1), Ll. Amat (2) y S. Querol (1)
Banc de sang de cordó umbilical de Barcelona (bcB). Institut de Recerca Oncològica, Hospital Sant Joan de Déu. Barcelona
Durante la gestación, la placenta y la circulación sanguínea feto-plancentaria cubren un importante número de funciones imprescindibles para el correcto desarrollo fetal. A pesar de ello, hasta hace poco, la placenta y la sangre contenida en ella han sido consideradas productos de desecho después del alumbramiento.
Lógicamente, unas estructuras tan cruciales durante el largo periodo de la gestación debían poseer características que podían ayudar a entender ciertas áreas de la ontogenia y, en última instancia, ser de alguna utilidad.
Hasta hace unos años, el reducido conocimiento que se poseía de éstas era un exponente más de la limitación de los métodos de investigación y análisis vigentes.
En el ámbito de la hematología, el desarrollo de nuevas posibilidades de estudio fenotípico y funcional de las células madre y progenitores hemopoyéticos hizo que, durante los ochenta, numerosos investigadores volvieran a profundizar en el estudio de la ontogenia hemopoyética. Entre otras cosas, se descubrió que la sangre de la placenta, fácilmente accesible a través de la punción de la vena umbilical, posee unas cualidades diferentes de la sangre adulta e incluso de la sangre de recién nacidos varios días después del parto.
Dos de estas cualidades son de especial relevancia:
- La sangre placentaria posee una concentración relativamente elevada de células madre hemopoyéticas de gran capacidad proliferativa.
- Las células responsables de la respuesta inmune son relativamente naives, como posible exponente de la tolerancia feto-materna y la falta de contactos previos con antígenos externos.
Estas características convirtieron la sangre de cordón umbilical (SCU) en una fuente de progenitores hemopoyéticos potencialmente útil en trasplantes; hecho que se demostró en modelos animales y, posteriormente, en una primera experiencia clínica exitosa publicada en 1989 por E. Gluckman. Se trataba de un niño que sufría una aplasia de Fanconi que recibió un trasplante de SCU de su hermano recién nacido.
Una vez demostrada la capacidad de implante de los progenitores de la SCU entre familiares histocompatibles, la mayor permisividad inmunológica de las células inmunocompetentes de la SCU y contando, además, con la experiencia previa del desarrollo estratégico de los registros de donantes no emparentados de médula ósea, se propuso la utilización de donaciones no emparentadas con el objetivo de completar el abanico de posibles donantes alternativos de progenitores hemopoyéticos. Ello podía mejorar las expectativas (y de hecho así ha sucedido) del 60/70% de pacientes que carecen de un donante familiar idóneo.
Para posibilitar esta estrategia ha sido necesario el desarrollo de programas de donación, obtención, manipulación y almacenamiento de la SCU; en resumen, la creación de los bancos de sangre placentaria o de cordón umbilical (BSCU), a fin de poder suministrar este producto, con las máximas garantías de calidad, a los centros de trasplante.
En este sentido, a pesar de la limitación que le confiere su escaso volumen y contenido de progenitores obtenidos, la SCU tiene una serie de ventajas adicionales sobre la MO procedente de registros de donantes no emparentados:
- Menor incidencia y mejor control de enfermedades transmisibles.
- Disponibilidad casi inmediata.
- Ausencia de pérdidas del registro.
- Menor coste económico.
El banco de sangre de cordón umbilical de Nueva York fue el pionero, iniciando su actividad en 1993, y también fue el primero que suministró una unidad de SCU no emparentada, durante el mismo año, para la realización del primer trasplante de este tipo en la Duke University de Durham.
A esta iniciativa se sumaron los BSCU de Milan, Duesseldorf y Barcelona, entre 1994 y 1995, a los que progresivamente se sumaron otros hasta un total de más de 50 en el año 2000. En la actualidad, hay más de 70.000 unidades de SCU disponibles, de las cuales aproximadamente la mitad están en BSCU Europeos y se han realizado más de 1.500 trasplantes.
Generalmente, los BSCU reportan sus unidades a los registros nacionales (en España, el Registro Español de Donantes de Médula Osea REDMO patrocinado por la Fundación Internacional José Carreras) e internacionales (Bone Marrow Donors Word Wide BMDW, National Marrow Donors Program NMDP).
En 1998, los BSCU pioneros en Europa (Milan, Duesseldorf, Barcelona) crearon el embrión de una organización internacional, NETCORD, a la que posteriormente se han sumado los bancos de Londres, París, Bélgica, Tokio, Denver, San Luis, Nueva York y Leiden. Esta organización tiene como objetivos garantizar la calidad de los productos transplantables, facilitar la interacción con los centros de trasplante o registros, facilitar el análisis de los resultados clínicos y promocionar la investigación sobre este producto hemopoyético.
Los primeros pasos en esta dirección han sido la creación de unos estándares de calidad de alcance internacional, asociados a la Foundation for the Acreditation of Hemopoietic Cell Therapy (FAHCT) y el desarrollo de una estrategia informática de comunicación en forma de Oficina Virtual.
Paralelamente, en Europa, gracias a una financiación de la CE se ha desarrollado el proyecto EUROCORD que coordina la investigación clínica en trasplante de SCU.
De los primeros análisis clínicos (grupo EUROCORD, BSCU de Nueva York, Universidad de Minesotta y la Universidad de Duke) se desprenden ya una serie de conclusiones relevantes:
- La SCU es capaz de implantar correctamente en la mayoría de los pacientes, aunque la velocidad de este implante es menor que la que se obtiene con progenitores de médula ósea o sangre periférica.
- La incidencia de complicaciones inmunológicas, como la enfermedad del injerto contra el huésped (EICH), es comparativamente menor y por ello,
- El trasplante de SCU es más permisivo en cuanto a su histocompatibilidad, y
- Los resultados clínicos, en términos de recuperación inmunológica y supervivencia, son comparables a los obtenidos con médula ósea o sangre periférica adulta de donantes no emparentados.
En este contexto, los BSCU juegan un papel crucial ya que son el primer eslabón que condiciona el resultado clínico final. Estos deben conjugar una serie de estrategias, técnicas y funciones encaminadas a la obtención de un producto con las máximas garantías de calidad. A fin de documentar esta serie de procedimientos utilizaremos el hilo conductor del sistema organizativo de nuestro BSCU.

El Banco de Sangre de Cordón Umbilical de Barcelona (bcB)
El bcB se constituyó en septiembre de 1995 con el objetivo de almacenar 10.000 unidades de SCU perfectamente caracterizadas y de óptima calidad para su uso en programas clínicos de trasplante no emparentado.
La actividad del bcB se desarrolla en dos áreas de actuación: el área obstétrica y el laboratorio de procesamiento/almacenamiento.
Área de obstetricia
La colecta de las unidades de SCU se realiza en el ámbito de cuatro maternidades y un área de atención primaria (Hospital Sant Joan de Déu, Institut Universitari Dexeus, Hospital de Mollet, Hospital General y Programa de Atención a la Mujer (PAD) de Granollers ).
Las donantes son incluidas en el programa durante la gestación. Para ello es necesario descartar antecedentes personales y familiares de enfermedades transmisibles, genéticas o infecciosas, y la realización de análisis durante el embarazo, para descartar las infecciones por HIV, hepatitis y sífilis. Las madres seleccionadas e informadas apropiadamente firman un consentimiento para la donación previo al parto.
Todas las madres incluidas en el programa con una gestación que supere las 32 semanas son potenciales candidatas a la recogida de SCU existiendo unos criterios consensuados de exclusión.
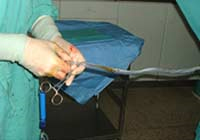
La SCU se obtiene cuando la placenta está in utero y el recién nacido ha sido separado de la placenta. La recogida de la SCU la realiza personal sanitario, médico o diplomado, distinto del personal que asiste directamente el parto. La técnica es rápida y, de manera resumida, incluye el doble clampaje y sección del cordón umbilical, aseptización y punción de la vena umbilical, seguida del drenaje por gravedad en la bolsa, cooperando mediante expresión suave del cordón. Frecuentemente se practica una segunda punción.
Una vez recogido el máximo volumen posible se espera al alumbramiento de la placenta, cuyas venas se puncionan para obtener sangre para las pruebas complementarias. Así mismo, se guarda un fragmento de cordón en el frasco correspondiente. Se realiza un seguimiento clínico y analítico de la madre y el recién nacido durante el puerperio hospitalario, después de la cuarentena y, si es posible, a los seis meses, registrándose todas las incidencias que presenten la madre y el recién nacido.
Área de procesamiento
El procesamiento comprende varias fases:
- Caracterización inicial del producto: recuento de células nucleadas, citología convencional, estudio HLA y grupo sanguíneo.
- Reducción de volumen: Mediante sedimentación en Hidroxi-etil-almidon (HES) y centrifugación, y
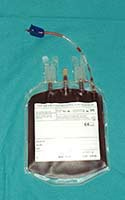
- Criopreservación en una solución de composición final: DMSO 10%, Dextrano 40 1% y HES 0,8% en plasma. La criopreservación y almacenamiento se realiza en el sistema Bioarchive (Thermogenesis). Este sistema congela controladamente hasta dos unidades cada 20 minutos y las almacena automáticamente, registrando informáticamente todo el proceso.
De cada unidad criopreservada se conservan muestras paralelas para controles posteriores: células y plasma de la madre del día del parto, plasma de la sangre de cordón, fragmento tisular de cordón umbilical, células de SCU obtenida de las venas placentarias.
Durante la visita de cuarentena se obtiene una muestra de sangre para realización de pruebas de screening serológico de enfermedades transmisibles.
Gestión de datos
Todas las unidades son registradas, respetando la confidencialidad, con un código interno. Las unidades validadas son incluidas en dos registros de datos con la información mínima necesaria para la búsqueda: código, células nucleadas criopreservadas, volumen inicial obtenido y HLA (A,B, DRB1). Estos registros, como se ha mencionado, son el REDMO (nacional) y NETCORD (internacional).
A través de estos registros se pueden consultar las unidades. Si existe alguna compatible con un paciente, el centro de trasplante puede ponerse en contacto directo con el banco para realizar las gestiones necesarias para el envío de la muestra.


Actividad del bcB
Desde su creación hasta marzo de 2001, el bcB ha recibido 4.294 unidades de SCU, de las cuales 3.303 reunieron los requisitos técnicos para ser procesadas. De estas, finalmente 3.150 fueron validadas y aptas para trasplante, siendo comunicadas a REDMO y NETCORD listas para su utilización.
La edad media de las gestantes ha sido de 29 años. El volumen medio obtenido ha sido 115 ml ± 33 (incluyendo anticoagulante). Las CN obtenidas han sido 13,71×108 ± 6,61, de las cuales un 0,30% ± 0,18 expresan el antígeno CD34. La media de unidades formadoras de colonias obtenida fue de 2,01×106 y de células CD34+ de 4,11×106.
Durante el periodo antes mencionado se han recibido 559 peticiones de estudio de idoneidad de las unidades almacenadas que, finalmente, han generado 80 trasplantes, seis de los cuales han sido realizados mediante coinfusión de productos sometidos a expansión ex vivo.
Los países y número de trasplantes realizados con unidades de nuestro banco han sido: Alemania (1), Argentina (6), Austria (1), Brasil (1), Canadá (1), España (37), Francia (2), Gracia (1), Israel (1), Italia (11), Portugal (1), Chequia (1), EE. UU. (16).
La supervivencia media a un año de los pacientes trasplantados con unidades de SCU de nuestro banco es cercana al 40%, que es similar a la que han observado otros BSCU.
Como conclusión, basada en parte en nuestra experiencia, se puede afirmar que las características funcionales de las células madre y progenitores hemopoyéticos de la SCU confieren a este producto una mayor capacidad de proliferación que redunda en una mayor probabilidad de injerto con dosis celulares reducidas. Además, el escaso contenido de células T que acompañan al trasplante, que son mayoritariamente naive, se traduce en una menor incidencia de la EICH sin aumentar las tasas de recaída.
La posibilidad de disponer donantes de forma ilimitada, la disponibilidad inmediata de las células de SCU criopreservadas, y la mejor tolerancia del trasplante en términos de EICH hacen que esta fuente de precursores hemopoyéticos sea atractiva en el trasplante a partir de donantes alternativos no emparentados.
El problema actual más relevante es la mortalidad, por infecciones y hemorragias, generada por los largos periodos de aplasia que siguen al trasplante. Por ello, los bancos de sangre de cordón deben esforzarse para ofrecer unidades con la mayor calidad hemopoyética posible.
En este sentido, la maternidad es una pieza clave ya que del personal comprometido en el programa depende, en gran medida, la calidad final del producto.
Nuevas posibilidades de los BSCU
Como se ha indicado anteriormente, a pesar de que los trasplantes de SCU son una buena opción en un número creciente de indicaciones clínicas, existen problemas que precisan ser resueltos. Algunos son similares a los de otros trasplantes hemopoyéticos, como la EICH , pero otros como la velocidad e implante e infecciones víricas tienen una significación especial en los trasplantes de SCU.
Tomando en cuenta el gran potencial proliferativo de las células hemopoyéticas de la SCU, se ha propuesto la expansión ex vivo de una fracción de la unidad de SCU como una vía para obtener grandes cantidades de progenitores potencialmente capaces de acelerar el implante hemopoyético.
En la misma dirección, parte del contenido de la unidad de SCU puede ser utilizado en la producción de células inmunocompetentes: células dendríticas, linfocitos T, etc, sensibilizados ante dianas específicas como peptidos bacterianos y víricos.
Además, las característica únicas de la sangre fetal y neonatal, que hoy ya sabemos que también contiene células madre no hemopoyéticas (p.e., células madre mesenquimales) con una elevada plasticidad, apoyan la posibilidad de generar diferentes tejidos como cartílago, hueso, cardiomiocitos, hepatocitos, células epiteliales, etc. Todos estos productos celulares pueden candidatos potenciales a estrategias de transferencia génica.
Considerando todas estas posibilidades, es razonable predecir que, en un futuro cercano, los BSCU podrán evolucionar hacia auténticas factorías celulares que soportarán un amplio espectro de actividades terapéuticas.
Referencias
- Gluckman E, Broxmeyer HE, Auerbach AD et al. Hematopoietic reconstitution in a patient with Fanconi’s anemia by means of umbilical-cord blood from an HLA-identical sibling. New Engl J Med 1996; 335:157-66.
- Broxmeyer HE, Douglas GW, Hangoc G et al. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells. Proc Natl Acad Sci USA 1989; 86;3828-32.
- Rubinstein P, Taylor PE, Scaradavou A et al. Unrelated placental blood for bone marrow reconstitution: organization of the placental blood program. Blood Cells 1994; 20: 587-600.
- Gluckman E. European organization for cord blood banking. Blood Cells 1994; 20: 600-8.
- Kögler G, Callejas J, Hakenberg P et al. Hematopoietic transplant potential of unrelated cord blood: critical issues. J Hematother 1996; 5: 105-16.
- Lazzari L, Corsini C, Curioni C et al. The Milan cord blood bank and the Italian cord blood network. J Hematother 1996; 5: 117-22.
- Rubinstein P, Carrier C, Scaradavou A, Kurtzberg J, Adamson J, Migliaccio, AR, Berkowitz RL, Cabbad M, Dobrila NL, Taylor PE, Rosenfield RE, Stevens CE. Outcomes among 562 recipients of placental-blood transplants from unrelated donors. N Engl J Med. 1998;339:1565-77.
- Rubinstein P, Adamson JW, Stevens C. The Placental/Umbilical Cord Blood Program of the New York Blood Center. A progress report. Ann N Y Acad Sci. 1999; 872:328-34.
- Locatelli F, Rocha V, Chastang C, Arcese W, Michel G, Abecasis M, Messina C, Ortega J, Badell-Serra I, Plouvier E, Souillet G, Jouet JP, Pasquini R, Ferreira E, Garnier F, Gluckman E. Factors associated with outcome after cord blood transplantation in children with acute leukemia. Eurocord-Cord Blood Transplant Group. Blood. 1999;93:3662-71.
- Sirchia G, Rebulla P. Placental/umbilical cord blood transplantation. Haematologica. 1999; 84:738-47.
- Rubinstein P, Dobrila L, Rodsenfield R et al. Processing and cryopreservation of placental/umbilical CB for unrelated marrow reconstitution. Proc Natl Acad Sci USA. 1995;92:10119-22.
- Gluckman E, Rocha V, Chastang C. Cord blood banking and transplant in Europe. Eurocord. Vox Sang. 1998;74 Suppl 2:95-101.
- Capmany G, Querol S, Cancelas JA, Garcia J. Short-term, serum-free, static culture of cord blood-derived CD34+ cells: effects of FLT3-L and MIP-1alpha on in vitro expansion of hematopoietic progenitor cells. Haematologica. 1999;84:675-82.
- Srour EF, Abonour R, Cornetta K, Traycoff CM. Ex vivo expansion of hematopoietic stem and progenitor cells: are we there yet? J Hematother 1999;8:93-102.
- Querol S, Gabarro M, Amat L, Gonzalez S, Gomez MD, de la Calle O, Madoz P, Badell I, Garcia J. The placental blood program of the Barcelona Cord Blood Bank. Bone Marrow Transplant. 1998;22 Suppl 1:S3-5.
- Fibbe WE, Noort WA, Schipper F, Willemze R. Ex vivo expansion and engraftment potential of cord blood-derived CD34+ cells in NOD/SCID mice. Ann N Y Acad Sci. 2001 Jun;938:9-17.
- Turgeman G, Pittman DD, Muller R, Kurkalli BG, Zhou S, Pelled G, Peyser A, Zilberman Y, Moutsatsos IK, Gazit D. Engineered human mesenchymal stem cells: a novel platform for skeletal cell mediated gene therapy. J Gene Med. 2001 May-Jun;3(3):240-51.
Agradecimientos
A los donantes.
A todo el personal sanitario, técnico y administrativo que colabora en el bcB.
Proyecto financiado en parte con la ayuda FIS 97/2120, por el Servei Català de la Salut y por la Fundación José Carreras para la lucha contra la leucemia.

