11 Nov 2014 El Síndrome Alcohólico Fetal
Marín M.P (1), Esteban-Pretel G. (1), Ballestín, R. (1), Romero A.M. (1), Megías L. (2) y Renau-Piqueras J. (1)
(1) Sección de Biología y Patología Celular, Hospital La Fe, València
(2) Departamento de Anatomía y Embriología Humana, Facultad de Medicina, Universidad de Granada
RESUMEN
La exposición prenatal al etanol puede causar un síndrome que incluye malformaciones craneofaciales y reducción de la masa cerebral, las cuales pueden estar asociadas a una amplia variedad de alteraciones neuroconductales. Este síndrome es conocido como síndrome alcohólico fetal (SAF) siendo su incidencia de dos casos cada mil niños nacidos vivos. Este es el extremo de dicho efecto, pero existe una gradación de alteraciones inducidas por el etanol sobre el desarrollo del sistema nervioso central (SNC) cuya incidencia alcanzaría el 1% de todos los niños nacidos vivos. Los mecanismos moleculares por los que el etanol ejerce estos efectos teratógenos no están bien dilucidados y para ello se están utilizando diversos modelos animales y otros in vitro.
Antecedentes
El alcohol etílico o etanol es una sustancia con alta capacidad adictiva siendo una de las principales drogas de abuso, estando considerada, además, junto con los hipnosedantes y opioides, como «depresor de la actividad funcional cerebral». Las Encuestas Domiciliarias sobre Abuso de Drogas en España (EDADES )1995-2005, realizadas por la Delegación del Gobierno para el Plan Nacional sobre Drogas (DGPNSD), dirigidas a la población de 15 a 64 años, ponen de manifiesto que el alcohol sigue siendo la sustancia psicoactiva con un consumo más extendido entre la población española. De hecho, España ocupaba en el año 2003 el sexto lugar en el ranking de consumo mundial de alcohol, con diez litros de alcohol puro per cápita. La mayor parte de los daños y costes sociosanitarios asociados al alcohol se producen en sujetos consumidores aparentemente no dependientes. Los estudios señalan que un buen número de urgencias y de ingresos hospitalarios junto con los accidentes mortales de tráfico están asociados al consumo de alcohol (Comisión Clínica de la Delegación del Gobierno para el Plan Nacional Sobre Drogas, Informe sobre alcohol, febrero 2007).
Actualmente, se admite que el consumo de alcohol (etanol) durante la gestación puede inducir graves daños en el desarrollo del feto (Renau-Piqueras y Guerri, 2002). Aunque hay autores que refieren que este conocimiento está ya contenido en textos antiguos como la Biblia (Jueces 13,7: «Y díjome: He aquí que tú concebirás, y parirás un hijo; por tanto, ahora no bebas vino, ni sidra…») o en escritos de Aristóteles (Problemata), otros autores ponen en duda dichas interpretaciones de estos textos (Abel, 1999). De una forma mejor documentada los efectos adversos del consumo materno de alcohol durante la gestación se conocen desde finales del siglo XIX cuando, en 1899, William Sullivan, describió que el número de abortos y mortalidad infantil era superior en mujeres alcohólicas que en abstemias, concluyendo que la intoxicación alcohólica de las madres era la principal causa del daño y muerte fetal (Sullivan, 1899). Este trabajo pasó inadvertido y no es hasta mitad del siglo XX cuando aparecen algunos estudios que describen malformaciones y alteraciones en niños que han estado expuestos intrauterinamente al alcohol.
En 1967, Lamache, tras evaluar las causas de las anomalías que padecían 3.352 niños, publicó un informe en el que describe que un 37% de los niños con deficiencias físicas y psíquicas (1.245 niños) eran hijos de padres alcohólicos. En un trabajo publicado por Lemoine et al. en 1968, que incluye 127 hijos de madres alcohólicas, se señala que todos ellos presentan una serie de características comunes entre las que se incluyen: alteraciones cráneo-faciales, retraso del crecimiento, hiperactividad, retraso mental y alteraciones psicomotoras. En este trabajo se sugiere por primera vez la existencia de una correlación entre los diferentes grados de afectación en el niño y la gravedad del alcoholismo materno. Posteriormente, en 1973, Jones y Smith describen un patrón de malformaciones comunes en ocho niños nacidos de madres alcohólicas, y lo denominan Fetal Alcohol Síndrome (FAS) o Síndrome Alcohólico Fetal (SAF) en castellano.
Estas características las dividen en tres grupos:
- Deficiencias en el crecimiento pre y postnatal.
- Alteraciones cráneo-faciales (microcefalia, filtrum poco desarrollado, fisuras palpebrales cortas, y malformación del área maxilar).
- Graves disfunciones del sistema nervioso central (SNC) (Jones et al., 1973).
En 1978, el mismo grupo (Clarren y Smith, 1978) publica, en base a 245 casos de SAF, la prevalencia de las características principales y asociadas a este síndrome. A partir de este momento la comunidad científica empieza a describir nuevos casos de SAF. Así mismo, mediante el uso de modelos experimentales animales, se demuestra que el alcohol es un potente teratógeno.
Características faciales del SAF y déficits en el crecimiento
Dado que la deficiencia mental y el retraso en el crecimiento son características comunes en muchos procesos patológicos, se ha realizado un gran esfuerzo para intentar definir con precisión el patrón cráneo-facial que se observa en niños con SAF, como posible marcador en el diagnóstico de este síndrome.
La cara «típica» de los niños con SAF muestra unas características comunes en todos ellos (ojos pequeños, pliegues epicánticos, desaparición del filtrum, labio superior delgado) y diferentes, en su conjunto, a los presentes en otros síndromes.
Distintos estudios demuestran, que junto a las alteraciones fenotípicas en los ojos (ej., fisuras palpebrales cortas, pliegues epicánticos), algunos pacientes con SAF presentan problemas importantes en el sistema visual, que parecen estar relacionados con la vulnerabilidad del sistema nervioso al efecto tóxico del alcohol, que se manifiesta también con una elevada frecuencia en los problemas auditivos presentes en niños con dicho síndrome (Connor et al., 1999). Estos déficits se han asociado a alteraciones en el cortex auditivo y cuerpo calloso.
Respecto a los déficits en el crecimiento asociados al SAF, numerosos trabajos han demostrado que tanto el consumo de altas como de bajas cantidades de alcohol durante la gestación induce déficits en el crecimiento pre y postnatal. De hecho, el 80 % de niños con SAF muestran déficits en la talla y peso corporal.
Disfunciones del sistema nervioso central en niños con SAF
Los niños con SAF son, habitualmente, microcéfalos en el momento del nacimiento y, generalmente, éste es el primer indicio indicativo de una disfunción del SNC. Los recién nacidos suelen ser irritables y temblorosos. Suelen efectuar una débil succión y con frecuencia muestran malestar ante cualquier estímulo sensorial (Sreissguth et al., 1978). El cerebro de niños con SAF es de pequeño tamaño, y presenta graves malformaciones estructurales. En autopsias de niños con este síndrome se han observado anomalías en el desarrollo neuronal y glial que se han interpretado como resultado de un fallo o una interrupción en las migraciones de estos tipos celulares (Clarren et al., 1978). La corteza y la sustancia blanca son reconocibles, pero ambas áreas son más delgadas de lo normal encontrándose grupos celulares heterotópicos que rodean los ventrículos dilatados y aparecen en la sustancia blanca. Igualmente, el cerebelo y la fosa posterior se encuentran frecuentemente reducidos de tamaño.
Las malformaciones cerebrales mayores, como son la anencefalia, porencefalia, mielomeningocele o la obstrucción del sistema ventricular con hidrocefalia, se presentan de forma ocasional en el SAF, y pueden ser interpretadas, también, como interrupciones específicas de la migración neuronal (Clarren, 1981; Wisniewski, et al., 1983).
Las alteraciones morfológicas descritas anteriormente se han relacionado con importantes alteraciones funcionales y cognitivas, que se manifiestan con retraso mental, disfunciones motoras, de memoria y aprendizaje. De hecho, las alteraciones a nivel del SNC son la consecuencia más dramática y permanente de la exposición prenatal al alcohol y se observan tanto en niños con el SAF completo como en individuos expuestos prenatalmente al alcohol que no presentan ninguna anomalía fenotípica. En la etapa preescolar los niños con SAF suelen ser hiperactivos, impulsivos, con deficiencia en la función motora tanto en movimientos finos como groseros, deficiencia en el lenguaje y problemas de comportamiento. En todas las etapas se suelen evidenciar déficits en la atención y función intelectual encontrándose un rango del coeficiente mental medio (CI) de 65.
Estudios de seguimiento de niños con SAF, en diferentes poblaciones indican que cuando estos niños llegan a la edad adulta, y aunque algunas características iniciales del SAF (disminución del peso y caracteres dismórficos faciales) son menos marcadas, los déficits en la función intelectual y cognitiva parecen acentuarse (Streissguth et al., 1994 a, b). Además, mediante la utilización de nuevas técnicas (tomografía de emisión de positrones y resonancia magnética nuclear) se ha demostrado que los niños con SAF presentan un volumen de cerebro más reducido, una disminución en el tamaño del cerebelo y anomalías en el desarrollo del vermis cerebelar, cerebro medio (agenesis e hipoplasia del cuerpo calloso), ganglio basal y diencéfalo. Todas estas alteraciones se han relacionado con los mencionados retraso mental, alteraciones cognitivas y del comportamiento en estos niños.
Otras consecuencias del consumo materno de alcohol durante la gestación
El consumo materno de alcohol durante la gestación no sólo puede dar lugar al SAF, sino que dependiendo de la dosis y patrón de consumo, puede inducir un espectro continuo de malformaciones fetales que se extienden de forma ininterrumpida desde los más leves, cuando el consumo de alcohol durante la gestación es esporádico, hasta los más graves en donde la madre es alcohólica y que da lugar al SAF.
Los niños diagnosticados de SAF completo, nacen generalmente de madres alcohólicas crónicas (Streissguth et al., 1983). Sin embargo, sólo de un 30% a un 45% de los hijos de estas madres presentan el cuadro completo mientras que el resto presenta un síndrome parcial, lo que ha supuesto un importante problema en la clasificación de estos efectos.
Inicialmente los efectos fetales relacionados con la exposición al etanol o SAF parcial se les denominó en la bibliografía anglosajona como FAE (fetal alcohol effects). Más recientemente, el Instituto de Medicina de Estados Unidos (IOM) publicó un informe en 1996 para el diagnóstico de los efectos fetales asociados al consumo materno de alcohol que incluye cinco categorías que, de forma resumida, son:
Categoría 1. SAF con confirmación de exposición maternal al etanol.
- Exposición maternal al etanol confirmada.
- Patrón característico de anomalías faciales.
- Retraso en el crecimiento.
- Anomalías en el desarrollo del SNC.
Categoría 2. SAF sin confirmación de exposición maternal al etanol.
Características 2-4 como en Categoría 1.
Categoría 3. SAF parcial con confirmación de exposición maternal al etanol.
- Exposición maternal al etanol confirmada.
- Algunos componentes del patrón facial.
- Retraso en el crecimiento como en Categoría 1.
- Anomalías en el desarrollo del SNC como en Categoría 1.
- Un patrón complejo de anomalías cognitivas o de conducta inconsistentes con el nivel de desarrollo e inexplicables por medios de la genética o por variaciones en las condiciones medioambientales (ejemplos: dificultad de aprendizaje, problemas en la percepción social, déficits en el lenguaje, poca capacidad de abstracción, etc).
Categoría 4. Defectos de nacimiento relacionados con el alcohol (Alcohol-Related Birth Defects, ARBD).
- Exposición maternal al etanol confirmada.
- Uno o más defectos congénitos incluyendo malformaciones y displasias del corazón, huesos, riñones, visión, o sistema auditivo.
Categoría 5. Desórdenes del desarrollo del sistema nervioso relacionados con el alcohol (Alcohol-Related Neurodevelopmental Disorder, ARND).
- Exposición maternal al etanol confirmada.
- Anomalías en el desarrollo del SNC como en Categoría 1 y/o 3. Patrón complejo de déficits cognitivos o de la conducta como en Categoría 3.
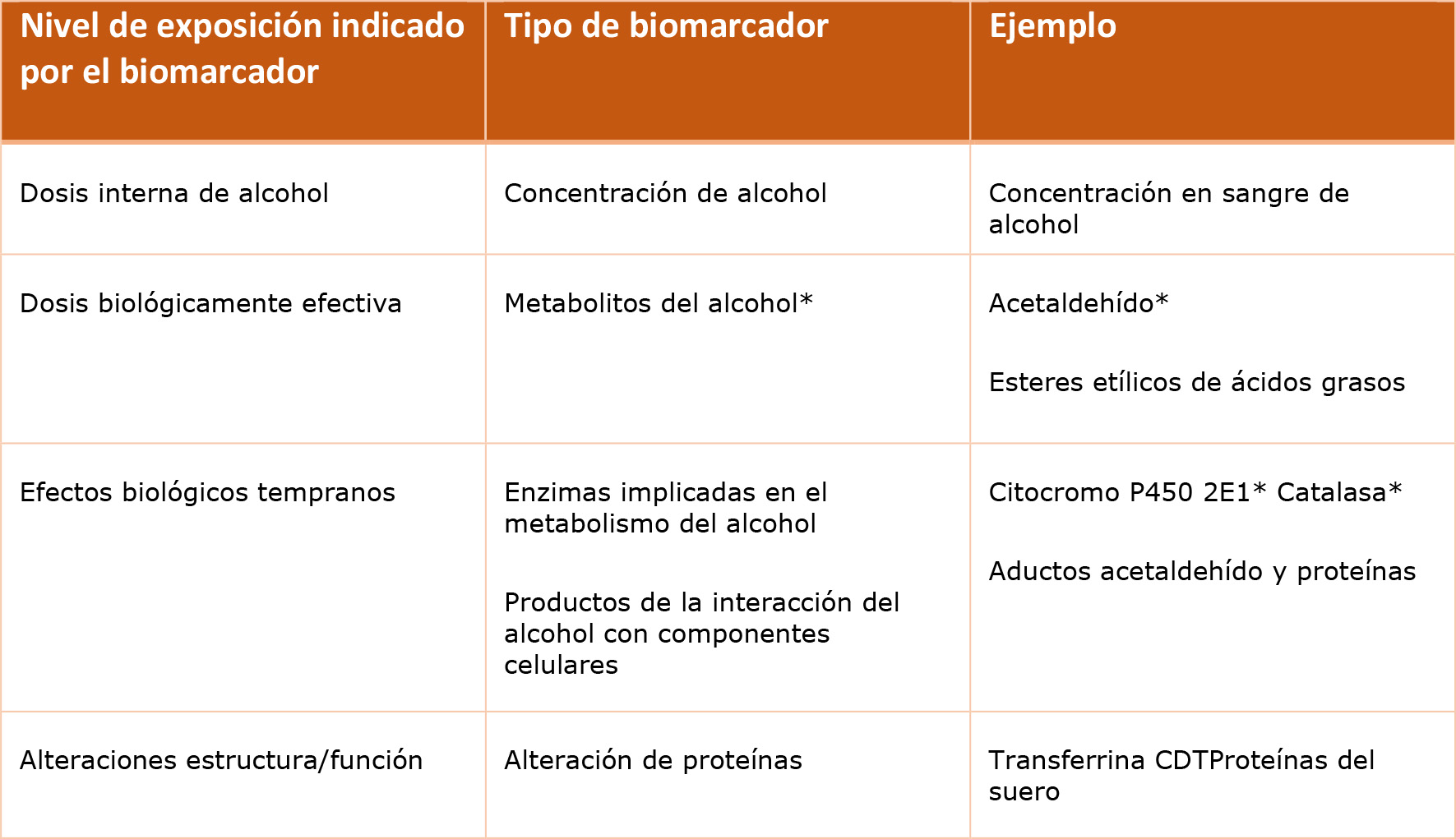
Uno de los problemas estriba en que la madre alcohólica o consumidora de alcohol reconozca dicho consumo y las pautas del mismo. Por tanto, la detección del consumo de alcohol en las mujeres embarazadas es un paso importante en la prevención del desarrollo de las alteraciones inducidas por la exposición prenatal al etanol. Además, la identificación temprana de estos niños podría conducir al establecimiento de nuevas modalidades de terapia. En este sentido, la utilización de biomarcadores del consumo materno de alcohol debería potenciarse y utilizarse en políticas de prevención primaria y secundaria.
En la siguiente tabla se indican algunos de estos biomarcadores (basada en Bearer, 2001).
* Existen tres vías principales en las que se produce una oxidación metabólica del etanol (Zakhari, 2006). La principal vía del metabolismo oxidativo en el hígado implica a la enzima alcohol deshidrogenasa (ADH) que se encuentra en el citosol. Este enzima transforma el etanol en acetaldehído, un bioproducto altamente reactivo y tóxico que contribuye al daño sobre las células y, probablemente, al proceso adictivo. El acetaldehído es metabolizado en la mitocondria principalmente por la enzima aldehído deshidrogenasa 2 (ALDH2) para formar acetato. La mayoría del acetato formado de esta manera pasa a la sangre y es metabolizado a CO2 en corazón, músculo esquelético y cerebro. El acetato no es un producto inerte pudiendo incrementar el flujo sanguíneo en el hígado, así como actuar como depresor en el SNC. El acetato también puede metabolizarse a acetil-CoA, implicado en la biosíntesis de lípidos y colesterol. Se ha sugerido que en situaciones de alcoholismo crónico el cerebro podría utilizar como fuente de energía acetato en lugar de glucosa.
El etanol también puede transformarse en acetaldehído por otras vías. En los peroxisomas, la enzima catalasa es capaz de oxidar el etanol a acetaldehído con el concurso de H2O2. Por último, el CYP2E1, presente predominantemente en las microsomas, asume un importante papel metabolizando el etanol a acetaldehído cuando la concentración de alcohol es elevada.
Prevalencia del Síndrome Alcohólico Fetal
La prevalencia del SAF es muy variable y depende de varios factores tales como diferencias en la cantidad o patrón de consumo de alcohol en la población estudiada, factores socioeconómicos, historial clínico de la madre (ej., consumo de otras drogas, nutrición), reconocimiento de este síndrome por los clínicos.
Los métodos epidemiológicos utilizados para estudiar la prevalencia y características del SAF, ARBD, y ARND han progresado sustancialmente, lo que ha permitido establecer un perfil general de aquellas madres con una mayor probabilidad de tener hijos con alteraciones debidas a la exposición prenatal al etanol. La prevalencia del SAF estimada por el IOM está entre 0,5 y 3,0 por cada 1.000 niños nacidos vivos, mientras que la prevalencia del SAF y ARBD combinados es de al menos el 1% de todos los nacidos vivos. Esta prevalencia confirma la percepción de muchos especialistas de que «la exposición prenatal al etanol es un problema muy grave y de que se trata de la causa conocida más importante de retraso mental en el mundo occidental».
Alteraciones asociadas al consumo moderado de alcohol
Evidencias clínicas indican que la ingesta de pequeñas cantidades de alcohol durante la gestación puede conllevar a alteraciones en la formación del SNC, que se manifiestan con déficits cognitivos y de comportamiento o ARND. Estas evidencias provienen de amplios estudios prospectivos en donde se han controlado variables tales como el estado socioeconómico y nutrición de la madre, el consumo de otras sustancias de abuso etc., y se ha tratado de relacionar la ingesta de alcohol y el patrón de consumo materno con las alteraciones físicas o de comportamiento en la descendencia.
Sin embargo, hay que destacar, que en estudios prospectivos en donde la madre ha consumido dosis muy bajas de alcohol durante la gestación (0,98-3,3 g etanol/día, equivalente a menos de una cerveza/día) no se observaron alteraciones en el lenguaje, en la comprensión y en la atención en niños de 3 y 6 años de edad.
Dosis umbral de alcohol
La dosis umbral o dosis «libre de riesgos» se podría definir como la cantidad de alcohol por debajo de la cual no se observan efectos adversos. Sin embargo, en humanos es difícil establecer esta dosis debido a las enormes diferencias genéticas e interindividuales, tanto en el metabolismo de alcohol como en la vulnerabilidad a este tóxico. De hecho, en el caso del alcohol no se ha podido establecer claramente este umbral, aunque existen algunos estudios que sugieren dosis por debajo de las cuales no se observan determinados efectos.
Por ejemplo, Jacobson y Jacobson (1994) no observan déficits intelectuales en niños cuyas madres han consumido menos de 14 g de etanol/día durante la gestación. Sin embargo, estos autores sugieren que esta dosis no se puede tomar como umbral ya que estos niños pueden tener otros déficits cognitivos que se manifiesten en la edad adulta, como se demuestra en el estudio de Streissguth et al. (1994 a,b). De hecho, esta autora sugiere que no existe dosis umbral para los efectos neurocomportamentales del alcohol y recomienda la abstinencia total durante la gestación (Streissguth, 1993).
Patrón de consumo de alcohol
Un dato importante que se ha demostrado en los últimos años es que el patrón de consumo de alcohol es un factor crítico importante en la aparición de los efectos fetales asociados al consumo de alcohol durante la gestación. Así, los estudios de Streissguth et al., (1990, 1994 b) demuestran que las alteraciones neurocomportamentales más graves las presentan niños de madres que han consumido 19 g de etanol/día durante el primer mes de embarazo o de madres que consumen esporádicamente 70 g de etanol en unas pocas horas. Igualmente se ha demostrado que los déficits funcionales más importantes se observan en niños que proceden de madres que han consumido en unas horas 42 g de etanol/semana (Jacobson and Jacobson, 1994). En este último estudio también se demuestra que, con un consumo equivalente de alcohol, la severidad de los déficits neurocomportamentales en el niño es mayor en aquellos cuyas madres tienen una edad superior a 30 años.
De acuerdo con estos resultados estudios en animales experimentales demuestran que los efectos adversos del alcohol durante el desarrollo fetal están directamente relacionados con los niveles de alcohol a que el feto está expuesto. Así, Bonthius y West (1990) demostraron que una misma cantidad de alcohol produce un mayor daño fetal cuando se consume concentrada en unas horas (en donde los niveles de alcohol que se alcanzan son muy elevados) que cuando la misma cantidad se toma espaciada en el tiempo.
Por tanto, las evidencias clínicas y experimentales demuestran que el consumo esporádico de altas cantidades de alcohol de forma aguda (ej., fines de semana) son mucho más dañinas para el desarrollo fetal que el consumo moderado durante toda la gestación.
Períodos críticos durante el desarrollo fetal en humanos
Aunque a partir de los estudios que se han realizado hasta el momento, es difícil establecer en qué fases de la gestación el feto es más vulnerable a los efectos adversos del etanol, algunos resultados clínicos y experimentales indican que el consumo de altas cantidades de alcohol al inicio de la gestación (primer mes de embarazo), es particularmente crítico para la aparición de malformaciones faciales y retraso mental.
Así, Ernhart et al. (1987) observaron una relación dosis-dependiente entre las anomalías craneofaciales en los niños y el consumo materno de alcohol (28-85 g etanol/día) alrededor del momento de la concepción. Estos autores también encontraron una relación entre dismorfia facial y desarrollo intelectual en los niños. Al mismo tiempo, Streissguth et al. (1990, 1994 a,b) demostraron que el consumo moderado (16 g etanol/día) antes o durante el primer trimestre de gestación se asociaba a déficits neurocomportamentales.
Sin embargo, Larsson et al. (1985) observaron que niños que habían estado expuestos durante toda la gestación (consumo materno de 28-85 g etanol/día) presentaban problemas más graves de hiperactividad, lenguaje, déficits motores, que aquellos cuyas madres habían interrumpido su consumo de alcohol durante el segundo trimestre. Estos resultados sugieren que el desarrollo de las diferentes funciones cerebrales posee su período crítico, y que la interrupción del consumo de alcohol siempre es beneficiosa para el desarrollo fetal.
Mecanismos de la acción teratogénica del alcohol
A pesar de la simplicidad química del etanol hoy en día no están claros los mecanismos por los que esta sustancia ejerce su acción teratogénica sobre el SNC y otros órganos, habiéndose postulado diferentes hipótesis que confirman que el etanol tiene múltiples dianas por lo que no es sorprendente que dañe al feto a través de distintos mecanismos algunos de los cuales se enumeran a continuación (Goodlett and Horn, 2001; Guerri et al., 2001; Goodlett et al., 2005).
- Transporte y captura (uptake) de glucosa: alguno de los efectos dañinos asociados a la exposición prenatal al etanol pueden deberse a la disrupción de la utilización de glucosa por parte del cerebro. Como es sabido, la glucosa realiza varias funciones cruciales en el cerebro.
- Muerte celular (necrosis o apoptosis): muchas de las acciones deletéreas del etanol sobre el organismo en desarrollo tienen como resultado final la muerte celular.
- Formación de radicales libres, estrés oxidativo y disfunción mitocondrial: un factor esencial que puede desencadenar el proceso de muerte celular es el estrés oxidativo, el cual puede producirse por el alcohol a través de varios mecanismos. Por ejemplo, algunas de las vías metabólicas del alcohol resultan en la generación de especies reactivas de oxígeno (ROS). Los niveles excesivos de ROS pueden dañar las células e inducir la muerte celular interfiriendo en la función mitocondrial. Por otra parte, el alcohol puede reducir los niveles de antioxidantes.
- Efecto sobre factores de crecimiento que regulan la proliferación y supervivencia celular: el etanol también puede dañar el cerebro a través de mecanismos que actúen inhibiendo la generación de nuevas células en el cortex cerebral durante el desarrollo.
- Efectos sobre las células gliales: el desarrollo normal del cerebro requiere no sólo neuronas sino el concurso de otras células no neuronales como son los astrocitos, que son necesarios para el crecimiento, desarrollo y función de las neuronas.
- Efectos sobre el desarrollo de sistemas neurotransmisores. Excitotoxicidad: otro mecanismo importante mediante el cual el alcohol afecta la estructura y función del cerebro en desarrollo es interfiriendo con la actividad de los neurotransmisores. En este contexto, la muerte neuronal también puede ser inducida por el exceso de actividad de determinados neurotransmisores, incluyendo el glutamato.
- Efectos sobre la adhesión celular: las neuronas necesitan establecer contactos con otras células durante su crecimiento y desarrollo para poder sobrevivir, migrar a su destino final y establecer conexiones adecuadas con otras células. Un número elevado de las llamadas moléculas de adhesión contribuyen al desarrollo de este proceso y se ha demostrado que el etanol puede actuar negativamente sobre algunas de ellas (L1, NCAM, etc.).
- Desregulación del timing o programa de desarrollo: para el correcto desarrollo del cerebro se requiere una regulación perfecta en el espacio y en el tiempo de la generación, migración y desarrollo de las neuronas, así como de la formación de las neuritas y de las sinapsis. El etanol puede alterar este timing afectando además el ciclo celular de los astrocitos y, por tanto, la gliogénesis.
- Fuentes secundarias de daño: incluyen función placentaria alterada, hipoxia, isquemia, etc.
Dentro de esta diversidad, uno de los mecanismos propuestos, por distintos laboratorios, incluyendo el nuestro, supone que el etanol alteraría la biosíntesis de glicoproteínas y su posterior transporte intracelular. Este efecto se ha analizado, dentro de las células del SNC, en astrocitos. El alcohol induciría la síntesis de glicoconjugados anormales (microheterogeneidad) junto a una retención de las proteínas que deben secretarse y que pueden ser de importancia en la regulación de procesos claves como la migración neuronal. Este mecanismo parece ser dependiente de una alteración inducida por etanol sobre aquellos elementos del citoesqueleto (microtúbulos y actina) implicados en el transporte vesicular, así como sobre algunas proteínas responsables de dicho transporte y sobre la integridad del aparato de Golgi (Tomás et al., 2005). Nuestro grupo también ha demostrado la existencia de microheterogeneidad en las glicoproteínas en neuronas como consecuencia de la exposición al etanol (Braza-Boils et al., 2006).
Modelos de estudio
Los investigadores han conseguido recrear la mayoría de las principales características del SAF en distintos modelos animales que incluyen el pollo, roedores, principalmente rata, y primates (Goodlett and Horn, 2001; Cud, 2005). Tales modelos permiten estudiar los efectos del alcohol sobre el desarrollo fetal en el contexto de un organismo intacto, y bajo una serie de condiciones controladas que pueden influir en el grado y extensión del daño inducido por la exposición al etanol sobre la estructura y función del SNC. Estos factores incluyen el patrón de consumo, los niveles de alcohol en sangre, el momento de consumo frente a la fase de desarrollo, el tipo celular, etc.
Puesto que los estudios con animales se emplean para simular las condiciones de consumo de alcohol durante la gestación, y puesto que los mamíferos utilizados como modelo tienen características fisiológicas, bioquímicas y genéticas en común con la especie humana, los hallazgos de dichos estudios pueden aportar información clave para comprender mejor los efectos de la exposición prenatal al etanol en humanos. Obviamente, estos resultados deben ser interpretados con cierta cautela, principalmente debido a la existencia de diferencias interespecíficas relativas a su vulnerabilidad frente al alcohol.
Por otra parte, los modelos animales no permiten un análisis detallado del efecto del etanol sobre la biología de determinadas células. Este tipo de análisis conducentes a establecer los mecanismos moleculares implicados en la acción del alcohol son posibles mediante el empleo de cultivos celulares. Estos modelos permiten controlar y manipular tanto las células como sus condiciones ambientales, lo que resulta fundamental para conocer los mecanismos que subyacen en la acción teratogénica del alcohol.
Referencias bibliográficas
- ABEL EL (1999) Was the feral alcohol syndrome recognized by the greeks and romans?. Alcohol & Alcoholism 34: 868-872.
- BEARER CF (2001) Markers to detect drinking during pregnancy. Alcohol Research and Health 25: 210-218.
- BONTHIUS DJ, WEST JR (1990) Alcohol-induced neural loss in developing rats: increased brain damage with binge exposure. Alcoholism: Clin Exp Res 14:107-118.
- BRAZA-BOILS A, TOMAS M, MARIN P, MEGÍAS L, SANCHO-TELLO M, FORNAS E, RENAU-PIQUERAS J (2006) Glycosylation is altered by ethanol in rat hippocampal cultures neurons. Alcohol & Alcoholism 41: 494-504.
- CLARREN SK (1981) Recognition of fetal alcohol syndrome. JAMA 245: 2436-2439.
- CLARREN SK, SMITH DW (1978) The fetal alcohol syndrome. N Engl J Med 298: 1063-1067.
- CLARREN SK, ALVOR EC, SUMI SM, STREISSGUTH AD, SMITH DW (1978) Brain malformations related to prenatal exposure to ethanol. J Pediatr 92: 64-70.
- CONNOR PD, STREISSGUTH AP, SAMPSON PD, BOOKSTEIN FL, BARR HM (1999) Individual differences in auditory and visual attention among fetal alcohol-affected adults. Alcoholism: Clin Exp Res 23:1395-1402.
- CUD TA (2005) Animal model systems for the study of alcohol teratology. Exp Biol Med 230:389-393.
- ERNHART CB, SOKOL RJ, MARTIER S, MORON P, NADLER D, AGER JW, WOLF A (1987) Alcohol teratogenicity in the human: A detailed assessment of specificity, critical period, and threshold. Am J Obstet Gynecol 156:33-39.
- GOODLETT CR, HORN KH (2001) Mechanisms of alcohol-induced damage to the developing nervous system. Alcohol Research and Health 25: 175-184.
- GOODLETT CR, HORN KH, ZHOU FC (2005) Alcohol teratogenesis: mechanisms of damage and strategies for intervention. Exp Biol Med 230:394-406.
- GUERRI C, PASCUAL M, RENAU-PIQUERAS J (2001) Glia and fetal alcohol syndrome. NeuroToxicology 22: 593-599.
- JACOBSON JL, JACOBSON SW (1994) Prenatal alcohol exposure and neurobehavioral development: Where is the threshold?. Alcohol Health and Research 18: 30-36.
- JONES KL, SMITH DW (1973) Recognition of the F.A.S. in early infancy. Lancet 2: 999-1001.
- JONES KL, SMITH DW, ULLELAND CN, STREISSGUTH AP (1973) Pattern of malformation in offspring of chronic alcoholic mothers. Lancet 2: 1267-1271.
- LAMACHE MA (1967) Communications: Reflections sur la déscendance des alcooliques. Bull Acad Nat Med 15: 517-521.
- LARSSON G, BOHLIN A-B, TUNELL R (1985) Prospective study of children exposed to variable amounts of alcohol in utero. Arch Dis Child 60:315-321.
- LEMOINE P, HAROUSSEAU H, BORTEYRU JP, MENUET, JC (1968) Lés enfants de parents alcooliques. Anomalies observeés a propos de 127 cas. Quest – Medical 21: 476-482.
- RENAU-PIQUERAS J, GUERRI C (2002) Síndrome alcohólico fetal y corazón. Rev Lat Cardiol 23: 57-65.
- STREISSGUTH AP, MARTIN JC (1983) The Pathogenesis of Alcoholism (KISSIN B, BEIGLITER H, eds.) Plenum Press, New York, pp.539-557.
- STREISSGUTH AP, BARR HM, SAMPSON PD (1990) Moderate prenatal alcohol exposure: Effects on child IQ and learning problems at age 7 ½. Alcoholism: Clin Exp Res 14: 662-669.
- STREISSGUTH AP, BOOKSTEIN FL, SAMPSON PF, BARR HM (1993) The enduring effects of prenatal alcohol exposure on child development, bird through 7 years: A partial least squares solution. Ann Arbor, MI University of Michigan Press.
- STREISSGUTH AP, BARR HM, OLSON CH, SAMPSON PD, BOOKSTEIN FL, BURGES DM (1994a) Drinking during pregnancy decreases word attack and arithmetic scores on standardized tests: Adolescent data from a population-based prospective study. Alcoholism: Clin Exp Res 18: 248-254.
- STREISSGUTH AP, SAMPSON PD, OLSON HC, BOOKSTEIN FL, BARR HM, SCOTT M, FELDMAN L, MIRSKY AF (1994b) Maternal drinking during pregnancy: Attention and short-term memory in 14-years-old offspring. A longitudinal study. Alcoholism: Clin Exp Res 18: 202-218.
- STREISSGUTH AP (1997) Fetal Alcohol Syndrome: A Guide for Families and Communities (BROOKES, PH, Publishing Co.) Baltimore, Maryland.
- SULLIVAN WC (1899) A note on the influence of maternal inebriety on the offspring. J Ment Sci 45: 489-503.
- TOMÁS M, MARÍN P, MEGÍAS L, EGEA G RENAU-PIQUERAS J (2005). Ethanol perturbs the secretory pathway in astrocytes. Neurobiol Dis 20: 773 – 784.
- WISNIEWSKI K, DAMBSKA M, SHEV JH, QAZI Q (1983) A clinical neuropathological study of the fetal alcohol syndrome. Neuropediatrics 14: 197-201.
- ZAKHARI S (2006) Overview: how is alcohol metabolized by the body?. Alcohol Research and Health 29: 245-255.
AGRADECIMIENTOS
Este trabajo ha sido financiado por FEPAD (FUNDACIÓN PARA EL ESTUDIO, LA PREVENCIÓN Y LA ASISTENCIA A LAS DROGODEPENDENCIAS), FIS (Red de Trastornos Adictivos (RTA), RD06/0001/0009) y MEC (SAF2005-00615).